ĐỘT PHÁ TRONG ĐIỀU TRỊ SUY TIM: VAI TRÒ NHÓM SGLT2i
GS.TS. Huỳnh Văn Minh
PHẦN 1: CƠ CHẾ BỆNH SINH TÁC DỤNG CỦA SGLT2i
Đại cương
SGLT2, viết tắt cụm từ Sodium-Glucose co-Transporter-2, còn gọi là SLC5A2 là một chất đồng vận chuyển natri-glucose nằm trên đỉnh của màng ống lượn gần (ÔLG) của đơn vị thận. SGLT2 chiếm hơn 90% quá trình tái hấp thu glucose ở thận, phần còn lại là qua trung gian của SGLT1(còn gọi là SLC5A1) nằm ở nhánh xuống của quai Henle. Gradient nồng độ glucose giữa tế bào chất và huyết tương thúc đẩy sự vận chuyển thụ động của glucose qua màng đáy về phía huyết tương, qua trung gian chất vận chuyển glucose 2 (GLUT2).Trong trường hợp không mắc bệnh đái tháo đường, glucose niệu xuất hiện khi mức đường huyết vượt quá 180 mg/dL. Tuy nhiên, ở những người có bệnh đái tháo đường, SLGT2 được điều hòa ngược lai, làm tăng tái hấp thu glucose trong ÔLG do đó làm tăng ngưỡng đường niệu lên đến # 220 mg/dL. Hoạt động của SGLT2 cần năng lượng được cung cấp bởi gradient Natri được tạo ra bởi men Na+/K+ ATP- ase nằm ở bề mặt tế bào biểu mô ÔLG, ngược lại với sự vận chuyển thụ động của glucose từ tế bào chất về phía huyết tương qua trung gian GLUT2 [ 3]. Sự ức chế SGLT2 sẽ gây ra glucose niệu với mức đường huyết thấp hơn ≈ 220 mg/dL miễn là trên 40–80 mg/dL (tùy thuộc vào chất ức chế SGLT2 được nghiên cứu). Khi mức đường huyết giảm, glucose niệu gây ra bởi chất ức chế SGLT2 giảm, giúp ngăn ngừa tình trạng hạ đường huyết. Mức độ đường niệu tỷ lệ với mức khởi đầu của glucose máu. Chất ức chế SGLT2 cho thấy tác dụng khiêm tốn trong việc giảm nồng độ glucose huyết tương, làm giảm HbA1C chỉ 0,5-1%. Sự bài tiết glucose trong nước tiểu đòi hỏi chức năng thận được bảo tồn ở mức độ vừa phải nhất, do đó chất ức chế SGLT2 chống chỉ định khi eGFR <30 ml / phút / 1,73m2 [3, 4].
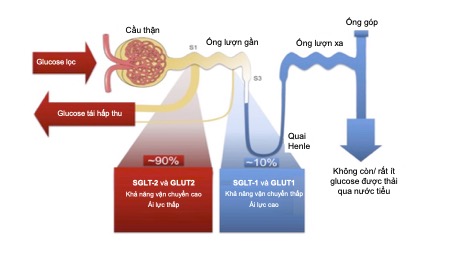
Hình 1: Vai trò điều hòa thể dịch của SGLT1,2 ở đơn vị thận
Cơ chế hoạt động bảo vệ Tim mạch
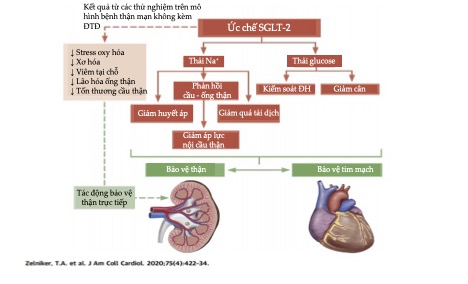
Sự ức chế SGLT2 làm giảm các biến cố về thận và khiến các nhà khoa học ngạc nhiên. Các phát hiện này được đưa ra một cách ngẫu nhiên bắt nguồn từ thông báo của FDA năm 2008 khi yêu cầu tất cả các loại thuốc đái tháo đường mới phải kiểm tra độ an toàn tim mạch[2]. Thay vào đó, thuốc lại được cho thấy khả năng giảm các biến cố TM ( tim mạch), kết cục thận, và tỷ lệ tử vong trên nhiều bệnh nhân. Việc phát hiện lợi ích TM được quy cho chất ức chế SGLT2 do đó thuốc được bổ sung vào nhóm thuốc có khả năng chống lại các nguy cơ TM. Câu hỏi đặt ra là tại sao nhóm thuốc này lại mang lại lợi ích như vậy?
Thuốc ức chế SGLT2 có tác dụng mạnh mẽ và nhất quán hơn về phòng ngừa ST ( Suy tim ) và các kết quả về thận hơn so với bệnh tim mạch do xơ vữa (ASCVD). Những nhận định này cho thấy phù hợp với cơ chế tác dụng của thuốc ức chế SGLT2 lên tim mạch và thận. Thứ hai, mặc dù điều trị bằng thuốc ức chế SGLT2 chỉ giảm nguy cơ các biến cố chính ( MACE ) ở mức độ vừa phải ở những bệnh nhân ASCVD đã mắc nhưng nhóm thuốc này làm giảm nguy cơ ST và kết cục thận bất kể đặc điểm nào của bệnh nhân [1]. Một số giả thuyết khác đã được công nhận về cơ chế bảo vệ TM do các chất ức chế SGLT2. Rõ ràng nhất là những cải thiện về nguy cơ ASCVD thông thường; tuy nhiên, mức độ lợi ích TM không tương xứng với những cải thiện khiêm tốn các yếu tố nguy cơ này [5]. Điều này cho thấy có sự hiện diện những cơ chế khác. Các cơ chế sinh lý bệnh của đái tháo đường làm phát triển bệnh tim mạch (BTM) phức tạp, liên quan đến những thay đổi huyết động, ảnh hưởng tái cấu trúc tim và thận, rối loạn điều hòa hormone,việc sử dụng năng lượng bị suy giảm, thay đổi kênh ion và điều chỉnh quá trình viêm và oxy hóa [6].
Các yếu tố nguy cơ tim mạch do xơ vữa động mạch thông thường
Sự ức chế SGLT2 cải thiện rối loạn chuyển hóa bệnh nhân, có khả năng làm giảm lượng đường huyết tương, huyết áp, trọng lượng cơ thể và thay đổi bilan lipid. Mức độ cải thiện những nguy cơ này khá khiêm tốn: HbA1C giảm ≈ 0,5–1%, tâm thu /huyết áp tâm trương giảm ≈ 4–6 / 1–2 mmHg (không làm tăng nhịp tim), trọng lượng cơ thể giảm ≈ 2–3 kg, và không thay đổi / tăng nhẹ cholesterol lipoprotein mật độ thấp (LDL-C) ≈ 1–2% (nhưng giảm nhẹ các hạt LDL dày đặc), tăng nhẹ cholesterol lipoprotein tỷ trọng cao (HDL-C) ≈ 2%, và giảm nhẹ triglyceride ≈ 8–9% [5, 7]. Các cơ chế hạ glucose huyết tương đã được giải thích ở trên. Để giảm huyết áp, nhiều yếu tố được cho là có liên quan và bao gồm tác dụng lợi tiểu và natri niệu (tiền tải), giảm độ cứng động mạch (hậu tải), cải thiện chức năng nội mô và giảm trọng lượng cơ thể [4, 9]. Giảm trọng lượng cơ thể thông qua bài tiết glucose qua nước tiểu ≈ 60–80 g mỗi ngày, giảm calo ≈ 240–320 kcal mỗi ngày [9]. Sự mất khối lượng mỡ có thể là do mất năng lượng do tổng hợp tăng đường niệu, phân giải lipid, quá trình oxy hóa axit béo, tạo xeton và tiếp xúc với glucagon, như cũng như giảm tiết insulin [10]. Giảm mô mở được quan tâm đáng kể do tác động qua lại giữa béo phì, đái tháo đường, viêm và BTM. Các cơ chế cơ bản về lipid vẫn còn khó nắm bắt nhưng được giả thuyết là sự kết hợp của sự thay đổi chuyển hóa năng lượng từ quá trình oxy hóa glucose thành chất béo, bài tiết calo qua nước tiểu, và sự huy động lipid tiếp theo được hiển thị bởi mô mỡ dưới da và nội tạng giảm [8]. Gần đây, một mô hình trên động vật đã chứng minh sự gia tăng LDL-C là kết quả của giảm thanh thải LDL-C trong huyết tương và tăng phân giải nhóm lipid lipoprotein giàu triglycerid (TRL) như lipoprotein tỉ trọng rất thấp (VLDL) thông qua kích thích lipoprotein lipase (LPL) [11]. Các liệu pháp giảm lipid khác làm tăng phân giải lipid của TRL, như fibrat và axit béo omega-3, cũng được chứng minh là làm tăng LDL-C do con đường trao đổi chất, với tác nhân, etyl icosapent làm giảm ASCVD đáng kể với mức giảm nhẹ TRL [12]. Mặc dù sự cải thiện của bất kỳ một trong các yếu tố nguy cơ thông thường là không đủ để giải thích lợi ích TM quan trọng nhưng khả năng là do cơ chế tác dụng phối hợp dường như hợp lý hơn.
Lợi tiểu / Thải natri
Bằng cách tăng đường niệu, và bài natri niệu, thuốc ức chế SGLT2 hoạt động tương tự như thuốc lợi tiểu vừa phải, ban đầu đào thải trung bình thêm ~ 300 mL mỗi ngày, rồi trở về mức ban đầu sau vài tuần điều trị [5]. Thuốc lợi tiểu và thải natri tác dụng làm giảm thể tích huyết tương, chủ yếu là natri, là chìa khóa để ngăn ngừa quá tải dịch và ST đợt cấp dẫn đến nhập viện [13]. Dapagliflozin được chứng minh làm giảm nồng độ natri ở da, điều này rất quan trọng vì theo một số dữ liệu cho thấy sự tương quan natri da với khối lượng tâm thất trái và huyết áp, được xem như một dấu hiệu của sự gia tăng thể tích [14]. Ngoài ra, việc giảm thể tích huyết tương do chất ức chế SGLT2 được thay thế bởi giảm dịch ở mô kẽ, là một cơ chế tốt hơn để giảm sung huyết mà không ảnh hưởng xấu đến sự tưới máu toàn thể [15]. Các tác dụng lợi tiểu và thải natri khác còn làm giảm áp lực làm đầy tâm thất, sức căng cơ tim và loạn nhịp thất, do đó có thể giúp giải thích việc giảm tử vong được thấy trong nghiên cứu EMPA-REG, thử nghiệm OUTCOME [5].
Hình 2: Tác dụng thải Na+ và đường niệu của nhóm thuốc ức chế SGLT2
Có sự khác biệt quan trọng giữa các chất ức chế SGLT2 so với các thuốc lợi tiểu thông thường (thiazide và lợi tiểu quai ). Thuốc ức chế SGLT2 tác dụng lợi tiểu bằng cách giảm thể tích kẽ ở một mức độ lớn hơn nhiều so với thể tích nội mạch, trong khi tác dụng này ngược lại với thuốc lợi tiểu thông thường. Điều này quan trọng vì bệnh nhân ST đã suy giảm nội mạch, sau đó làm giảm thêm bởi các thuốc lợi tiểu. Đặc tính duy nhất này giúp các chất ức chế SGLT2 tránh cơ chế bù trừ hoạt hóa giao cảm thần kinh nội tiết giúp ngăn cản sự tiến triển của ST [6]. Các tính năng nổi bật khác của nhóm thuốc này bao gồm tạo hồng cầu (không có với thuốc lợi tiểu thông thường), thải acid uric (thuốc lợi tiểu thông thường làm tăng axit uric), và chất điện giải trong huyết tương cải thiện (thuốc lợi tiểu thông thường gây ra rối loạn điện giải làm tăng nguy cơ loạn nhịp tim) [16]. Tăng bài tiết acid uric qua thận thông qua chất vận chuyển glucose 9 (GLUT9) trong ÔLG, làm giảm axit uric huyết tương ≈ 10–15% [5]. Tác dụng này cũng có thể góp phần vào việc bảo vệ TM vì nồng độ axit uric trong huyết tương có liên quan đến biến chứng TM bao gồm ST và bệnh thận [17].
Tác động trực tiếp lên cơ tim
Tái cấu trúc tâm thất
Đáp ứng huyết động học được tạo ra từ thuốc ức chế SGLT2 tạo môi trường thuận lợi giảm áp lực thủy tĩnh của tim, là cơ chế gây nên sự tái cấu trúc và phì đại tâm thất. Điều này gần đây đã được chứng minh trong nghiên cứu EMPA-HEARTCardiolink-6 (Ảnh hưởng của Empagliflozin trên cấu trúc timở bệnh nhân tiểu đường loại 2) nghiên cứu ngẫu nhiên 97 bệnh nhân tăng huyết áp có đái tháo đường típ 2 và bệnh mạch vành ổn định nhưng không có ST chênh, dùng empagliflozin 10 mg mỗi ngày hoặc giả dược trong 6 tháng và cho thấy TTT giảm đáng kể khối lượng - 2,6 so với - 0,01 g / m2 ở nhóm giả dược, p = 0,01 [18]. Phân suất tống máu thất trái cũng tăng 2,2% ở nhóm dùng empagliflozin.Vì khối lượng TTT là một yếu tố dự đoán mạnh mẽ về các biến cố tim mạch, nên những kết quả đều dựa vào tái cấu trúc TTT trong đánh giá lợi ích TM và ST qua các nghiên cứu kết cục CVOT lớn [18]. Giảm cả tiền tải và hậu tải được cho là đóng vai trò quan trọng trong việc giảm công tim và sự tiêu thụ oxy tim [6, 9]. Ngoài ra, xơ hóa cơ tim, kéo theo việc sửa chửa tái cấu trúc là kết quả của lắng đọng protein nền ngoại bào (ECM) bởi các nguyên bào sợi tim, đỉnh điểm là tâm thất không thích ứng, xảy ra trong giai đoạn cuối sinh bệnh học ST [6]. Các nghiên cứu trên động vật gần đây cho thấy thuốc ức chế SGLT2 cải thiện tình trạng xơ hóa cơ tim bằng cách ức chế sự chuyển dạng yếu tố tăng trưởng β/tổng hợp collagen, α-actin cơ trơn, yếu tố tăng trưởng mô liên kết, tái cấu trúc ECM và matrix metalloproteinase 2 [19]. Một con đường khác dẫn đến giảm xơ hóa tim gây ra bởi sức căng thành tim mãn tính có liên quan đến giảm hoạt động giao cảm. Thuốc ức chế SGLT2 làm giảm hoạt động thần kinh thận hướng tâm và ức chế cơ chế phản xạ trung ương kích hoạt giao cảm toàn thân. Kích hoạt lâu dài hoạt động giao cảm được tìm thấy ở bệnh nhân đái tháo đường typ 2 đóng một vai trò quan trọng trong sự phát triển tăng huyết áp, ST, và các biến chứng TM khác [20].
Ức chế trao đổi Na + / H +
Cơ tim suy làm giảm điều hòa chất trao đổi Na+/ H+(NHE)1 dẫn đến tăng natri và canxi trong tế bào, gây ra tình trạng tăng oxy hóa và tạo huyết khối [13]. Các hoạt động NHE1 gia tăng được cho là chỉ điểm ban đầu của tổn thương tế bào cơ tim, ST, và cuối cùng là tử vong TM [21].Mặc dù các thụ thể SGLT2 không được biểu hiện rõ ràng trong mô cơ tim, chất ức chế SGLT2 ức chế NHE1 trên tế bào cơ tim theo cơ chế chưa rõ . ST tiến triển cũng đã được chứng minh điều chỉnh NHE3 trong ÔLG thận, qua trung gian tái hấp thu Na và có khả năng kháng thuốc lợi tiểu và peptid lợi niệu natri nội sinh [22]. Thuốc ức chế SGLT2 ngăn chặn hoạt động của NHE3, dẫn đến thải natri và có thể tạo cơ chế bảo vệ tim thận với nhóm thuốc này[22].
Mỡ thượng tâm mạc
Mỡ thượng tâm mạc là mô mỡ nằm giữa cơ tim và lớp tạng của màng ngoài tim có một số tác dụng tại chỗ và toàn thân [23]. Trong bệnh đái tháo đường, sự đề kháng insulin sẽ làm tăng sự phân giải lipid và sự hấp thu axit béo và tích tụ triglycerid vào cơ tim, làm tăng nguy cơ tích tụ mỡ ở thượng tâm mạc . Mỡ thượng tâm mạc có có liên quan đến sự phát triển của xơ hóa tim, giảm co bóp, loạn nhịp tim và ST. Ngoài ra, tích tụ mỡ thượng tâm mạc được xem như một chỉ điểm tiên lượng sống còn trong ST. Các nghiên cứu gần đây về thuốc ức chế SGLT2 đã chứng minh khả năng làm giảm lượng mỡ ở thượng tâm mạc và do đó khả năng có lợi cho TM và ST [24]. Giả thuyết này đang được tiếp tục đánh giá trong một nghiên cứu lâm sàng đang tiến hành.
Tác dụng thận
Có mối quan hệ phức tạp giữa tim và thận như rối loạn chức năng ở một cơ quan này có thể dẫn đến rối loạn chức năng của cơ quan khác. Thêm vào sự phức tạp đó là đái tháo đường gây ra biến đổi có hại cho sự ổn định nội môi chức năng tim và thận. Kết quả tạo nên vòng luẩn quẩn và tự điều chỉnh giữa đái tháo đường, ST và suy thận.Tuy nhiên, chất ức chế SGLT2 có thể hóa giải bộ ba nguy hiểm này [4]. Tác dụng bảo vệ thận bởi chất ức chế SGLT2 chưa được làm sáng tỏ hoàn toàn nhưng có khả năng đa yếu tố, liên quan đến chất điện giải, mạch máu và biến đổi thủy tĩnh. Ức chế thụ thể SGLT2 trong ÔLG thận làm tăng bài tiết natri niệu và giảm thể tích dịch. Điều này sẽ làm giảm peptide lợi niệu nhĩ là chất gây co mạch của tiểu động mạch thận đến; đồng thời, sự gia tăng nồng độ natri trong ống lượn được nhận cảm bởi macula densa sẽ kích hoạt phản hồi màng đáy-cầu thận qua trung gian adenosine gây co mạch của tiểu động mạch đến và ức chế phóng thích renin từ các tế bào cận cầu thận sẽ gây ra sự giãn mạch của các tiểu động mạch đi. Sự kết hợp của sự co mạch của các tiểu ĐM thận đến và giãn mạch của các tiểu động mạch thận đi làm giảm áp lực thủy tĩnh trong cầu thận và do đó có tác dụng bảo vệ thận lâu dài [30]. Cao điểm những tác động này là cải thiện đáng kể bệnh lý thận, giảm tiến triển albumin niệu, tăng gấp đôi creatinin huyết thanh và làm chậm đi ghép thận. Bảo tồn chức năng thận có tầm quan trọng đặc biệt đối với bệnh nhân ST để tránh quá tải thể tích và kháng thuốc lợi tiểu [13].
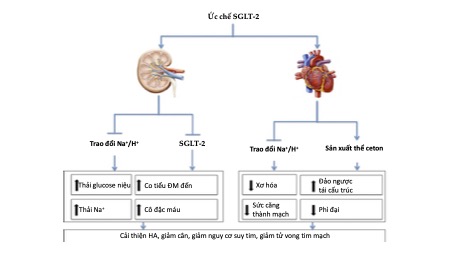
Hình 3: Tác dụng kép lên tim và thận của nhóm thuốc ức chế SGLT2
Đặc điểm thải natri niệu của chất ức chế SGLT2 dẫn đến giảm thể tích và giảm áp lực động mạch như đã nói ở trên sẽ kích hoạt renin-angiotensinaldosterone (RAAS) toàn thân và tại chỗ. Tuy nhiên, ức chế SGLT2 hoạt động theo lý thuyết sẽ kích hoạt đường RAAS không truyền thống, thụ thể angiotensin II loại 2 và thụ thể Mas, không phải là thụ thể angiotensin II loại 1. Kích hoạt thụ thể angiotensin II loại 1 góp phần vào cơ chế bệnh sinh của BTM (như là co mạch, giữ natri, viêm,oxy hóa, v.v.), trong khi hoạt hóa angiotensin loại 2 thụ thể II có liên quan đến cơ chế bảo vệ tim mạch (tức là, giãn mạch, bài tiết natri, chống viêm,chống phì đại, chống loạn nhịp tim, v.v.) [25]. Các nghiên cứu cho thấy sự gia tăng nồng độ renin và chất trung gian RAAS trong huyết tương ( như là, aldosterone, angiotensin II) và nồng độ angiotensinogen trong nước tiểu và ức chế men chuyển angiotensin đều đáp ứng với việc sử dụng chất ức chế SGLT2 [26].Tuy nhiên, những tác dụng này được ghi nhận ở bệnh nhân đái tháo đường typ 1 và khác nhau tùy theo tình trạng đường huyết, bình thường hay gia tăng.
Cô đặc máu/Tăng sinh hồng cầu
Ở bệnh nhân đái tháo đường, các tế bào biểu mô ở ÔLG tái hấp thu glucose quá mức đòi hỏi việc tăng sản xuất ATP thông qua quá trình phosphoryl oxy hóa. Nhu cầu oxy tăng lên gây ra thiếu oxy mô kẻ- ống lượn thận và làm suy giảm sản xuất erythropoietin ở nguyên bào sợi mô kẻ [27]. Thuốc ức chế SGLT2, bằng cách gây ra thải đường niệu, giảm hoạt của ÔLG thận làm đảo ngược tác dụng dẫn đến tăng hồng cầu và cải thiện sự cung cấp oxy đến các mô [28]. Một phân tích của thử nghiệm EMPA-REG OUTCOME cho thấy empagliflozin làm tăng hematocrit và hemoglobin là những chất trung gian quan trọng nhất của giảm tỷ lệ tử vong TM, chiếm ≈ 50% [29]. Sự gia tăng hematocrit ≈ 2–4% được cho là do giảm thể tích và kích thích tạo hồng cầu của thuốc ức chế SGLT2 [28]. Một lợi ích huyết động khác khi phân tích đường cong Kaplan-Meier còn cho thấy sự giảm tử vong TM sớm và nhập viện do ST (≈ 3 tháng) trong các biến cố tim mạch CVOT chính.
Nhu cầu trao đổi chuyển hóa
Ở người suy tim, việc sử dụng các chất chuyển hóa cơ bản bị suy giảm và quá trình oxy hóa axit béo tạo ra năng lượng có thể dẫn đến sự tích tụ các chất trung gian của axit béo tự do dẫn đến rối loạn chức năng tâm trương.Thuốc ức chế SGLT2 gây ra bài tiết glucagon từ tế bào α tuyến tụy và giảm tiết insulin dẫn đến sự thay đổi năng lượng sử dụng từ các axit béo tự do và glucose thành các thể xeton(chủ yếu là β-hydroxybutyrate) [30]. Sản xuất xeton được tăng lên không chỉ từ việc tăng hiệu ứng glucagon, mà còn có thể giảm bài tiết xeton ở thận [6]. Xeton trong cơ thể dễ dàng được mô cơ tim tiếp nhận, cung cấp một nguồn năng lượng thay thế hiệu quả hơn được chuyển đổi thành năng lượng cho tim (và thận), nên đòi hỏi sử dụng ít hơn ATP. Do đó, β-hydroxybutyrate đã được gọi là "siêu nhiên liệu" có khả năng giảm nhu cầu oxy và cải thiện chức năng tim và thận [31]. β-hydroxybutyrate cũng được cho là có đặc tính chống oxy hóa và chống loạn nhịp tim [32]. Ngoài ra, sự tăng tiết glucagon,có tác dụng tăng sự co bóp và chống loạn nhịp tim, có thể góp phần cải thiện hiệu quả và sự ổn định của tim [78]. Một sự khác biệt quan trọng khác về chuyển hóa là sự giảm lệ thuộc insulin vì cơ chế hoạt động làm giảm glucose của nó. Việc tránh sử dụng insulin và bài tiết glucose trong nước tiểu giảm ở mức glucose huyết tương thấp hơn do đó đều làm giảm nguy cơ hạ đường huyết đáng kể. Đây là sự phân biệt quan trọng giữa các thuốc chống đái tháo đường là hạ đường huyết có liên quan đến việc tăng nguy cơ TM [5].
Tác dụng chống viêm / chống oxy hóa
Viêm toàn thân, hậu quả của bệnh đái tháo đường và bệnh sinh phát triển của xơ vữa động mạch và tái cấu trúc tâm thất, đã xác định cơ chế liên quan tiềm năng của thuốc ức chế SGLT2. Các nghiên cứu trên động vật của chất ức chế SGLT2 cho thấy sự điều hòa các chất trung gian gây viêm và oxy hóa như leptin, interleukins (IL) [IL-6, IL-10, IL-1β], nucleotide gắn kết thụ thể giống oligomerization 3 (NLRP-3), caspase-1, yếu tố hoại tử khối u α (TNF-α), cyclo-oxygenase 2 (COX-2), tẩm nhuận đại thực bào tim, superoxide, nitrotyrosine, và bộ chuyển đổi tín hiệu và chất kích hoạt của phiên mã 3 (STAT3) [7]. Ngoại trừ dapagliflozin gây ra giảm (hsCRP) ở người, hầu hết các nghiên cứu này tiến hành trong thực nghiệm hoặc trên động vật để đánh giá tác dụng trên mô thận [81]. Hiện nay còn chưa biết nhiều về những tác động này đối với tim và cần điều nghiên thêm. Một thử nghiệm sơ bộ để đánh giá tác dụng chống oxy hóa của các chất ức chế SGLT2 đang được tiến hành.
Tác dụng lên SGLT1
Ngược lại với các thụ thể SGLT2 hầu như chỉ có nằm trong ÔLG thận, các thụ thể SGLT1 nằm nhiều ở các mô bao gồm ruột, tim, cơ xương và thận [5]. Sự biểu hiện của SGLT1 tăng lên trong tình trạng thiếu máu cục bộ tim hoặc bệnh cơ tim do đái tháo đường [36]. Các nghiên cứu trên động vật cho thấy sự biểu hiện quá mức của tim với thụ thể SGLT1 sẽ tạo ra phì đại cơ tim, rối loạn chức năng TTT và bệnh cơ tim nhưng có thể hồi phục bằng cách ức chế SGLT1 [37]. Các nguyên bào sợi tim khi có tăng đường huyết sẽ làm tăng metallo -proteinase-2, một loại enzyme liên quan đến xơ hóa tim, nhưng sẽ giảm đi với phlorizin (thuốc ức chế kép SGLT1 và SGLT2) [38]. Gần đây hơn, một nghiên cứu ngẫu nhiên Mendel về các biến thể sai lệch trong SGLT1 khi dùng chất ức chế SGLT1 sẽ dẫn đến giảm tần suất mắc bệnh đái tháo đường cũng như giảm việc khởi trị đái tháo đường, tử vong và ST. Với dữ liệu ban đầu đó có vẻ hứa hẹn hỗ trợ ức chế SGLT1 và giảm sinh bệnh học ST [39]. Hiện tại trong số các chất ức chế SGLT2 hiện hành, canagliflozin có tác dụng ức chế SGLT1 mạnh nhất; tuy nhiên, tác dụng của nó dường như bị giảm đi với các thụ thể trong ruột non, trong khi các thụ thể trong tim và thận không bị ảnh hưởng với các liều điều trị [40].
Kết luận
Thuốc ức chế SGLT2 thông qua cơ chế hoạt động độc đáo toàn diện của chúng được phát hiện từ một nhóm thuốc đái tháo đường thông dụng đã cải thiện kết quả liên quan bất ngờ liên quan đến suy tim, giảm tần suất nhập viện cũng như tử vong tim mạch. Các cơ chế bảo vệ tim mạch được tạo ra bởi các chất ức chế SGLT2 bao gồm tối ưu hóa kiểm soát các yếu tố nguy cơ vữa xơ động mạch, cải thiện huyết động, phòng ngừa tái cấu trúc tim và thận, ức chế rối loạn điều hòa hormone, sử dụng chất nền trao đổi chất hiệu quả hơn, tác dụng lên sự trao đổi Na+/H+, chống viêm và chống oxy hóa. Ngoài việc phân định chính xác cơ chế mà những loại thuốc này đã trình bày việc ứng dụng và kết quả các nghiên cứu được công bố những năm gần đây là những quyết định quan trọng liên quan đến các khuyến cáo trong thực hành điều trị suy tim sẽ được trình bày trong các bài tiếp sau./.
Cezary Wojcik; Bruce A. Warden. Mechanisms and Evidence for Heart Failure Benefits from SGLT2 Inhibitors. Current Cardiology Reports (2019) 21:130
Tài liệu tham khảo
1. Zelniker TA, Wiviott SD, Raz I, Im K, Goodrich EL, Bonaca MP, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet.2019;393:31–9.
2. Cefalu WT, Kaul S, Gerstein HC, Holman RR, Zinman B, SkylerJS, et al. Cardiovascular outcomes trials in type 2 diabetes: where dowe go fromhere? Reflections from a diabetes care editors’ expertforum. Diabetes Care. 2018;41:14–31.
3. Rieg T, Vallon V. Development of SGLT1 and SGLT2 inhibitors. Diabetologia. 2018;61:2079–86.
4. Zelniker TA, Braunwald E. Cardiac and renal effects of sodium glucose co-transporter 2 inhibitors in diabetes: JACC state-of-the heart review. J Am Coll Cardiol. 2018;72:1845–55.
5. Heerspink HJ, Perkins BA, Fitchett DH, Husain M, Cherney DZ. Sodium glucose cotransporter 2 inhibitors in the treatment of diabetes mellitus: cardiovascular and kidney effects, potential mechanisms, and clinical applications. Circulation. 2016;134:752–72 A comprehensive review of all systemic effects of SGLT2 inhibitors and how these integrate to ulitmately affect the heart.
6. Verma S, McMurray JJV. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia 2018;61:2108–2117. An excellent review of heart specific effects of SGLT2 inhibitors with exceptional images.
7. Yanai H, Hakoshima M, Adachi H, Kawaguchi A, Waragai Y, Harigae T, et al. Effects of six kinds of sodium-glucose
cotransporter 2 inhibitors on metabolic parameters, and summarized effect and its correlations with baseline data. Journal of clinical
medicine research. 2017;9:605–12.
8. Bays HE, Sartipy P, Xu J, Sjostrom CD, Underberg JA. Dapagliflozin in patients with type II diabetes mellitus, with and
without elevated triglyceride and reduced high-density lipoprotein cholesterol levels. Journal of clinical lipidology. 2017;11:450–
458.e1.
9. Solini A, Giannini L, Seghieri M, Vitolo E, Taddei S, Ghiadoni L, et al. Dapagliflozin acutely improves endothelial dysfunction, reduces aortic stiffness and renal resistive index in type 2 diabetic patients: a pilot study. Cardiovasc Diabetol. 2017;16:138.
10. Schork A, Saynisch J, Vosseler A, Jaghutriz BA, Heyne N, Peter A, et al. Effect of SGLT2 inhibitors on body composition, fluid status and renin-angiotensin-aldosterone system in type 2 diabetes: a prospective study using bioimpedance spectroscopy. Cardiovasc Diabetol. 2019;18:46.
11. Basu D, Huggins LA, Scerbo D, Obunike J, Mullick AE, Rothenberg PL, et al. Mechanism of increased LDL (low-density
lipoprotein) and decreased triglycerides with SGLT2 (sodiumglucose cotransporter 2) inhibition. Arterioscler Thromb Vasc
Biol. 2018;38:2207–16.
12. Bhatt DL, Steg PG, Miller M, Brinton EA, Jacobson TA, Ketchum SB, et al. Cardiovascular risk reduction with Icosapent ethyl for hypertriglyceridemia. N Engl J Med. 2019;380:11–22.
13. Lytvyn Y, Bjornstad P, Udell JA, Lovshin JA, Cherney DZI. Sodium glucose cotransporter-2 inhibition in heart failure: potential mechanisms, clinical applications, and summary of clinical trials. Circulation. 2017;136:1643–58. 130 Page 12 of 14 Curr Cardiol Rep (2019) 21:130
14. Karg MV, Bosch A, Kannenkeril D, Striepe K, Ott C, Schneider MP, et al. SGLT-2-inhibition with dapagliflozin reduces tissue sodium content: a randomised controlled trial. Cardiovasc Diabetol. 2018;17:5.
15. Hallow KM, Helmlinger G, Greasley PJ, McMurray JJV, Boulton DW.Why do SGLT2 inhibitors reduce heart failure hospitalization? A differential volume regulation hypothesis. Diabetes Obes Metab. 2018;20:479–87.
16. Lambers Heerspink HJ, de Zeeuw D, Wie L, Leslie B, List J. Dapagliflozin a glucose-regulating drug with diuretic properties in
subjects with type 2 diabetes. Diabetes Obes Metab. 2013;15:853–62.
17. Ferrannini E, Solini A. SGLT2 inhibition in diabetes mellitus: rationale and clinical prospects. Nat Rev Endocrinol. 2012;8:495–502.
18. Verma S, Mazer CD, Yan AT. EMPA-HEART CardioLink-6 trial: a randomized trial of empagliflozin on left ventricular structure, function, and biomarkers in people with type 2 diabetes and coronary heart disease. Chicago: AHA; 2018.
19. Lee TM, Chang NC, Lin SZ. Dapagliflozin, a selective SGLT2 inhibitor, attenuated cardiac fibrosis by regulating the macrophage polarization via STAT3 signaling in infarcted rat hearts. Free Radic Biol Med. 2017;104:298–310.
20. Sano M. A new class of drugs for heart failure: SGLT2 inhibitors reduce sympathetic overactivity. J Cardiol. 2018;71:471–6.
21. Buerke M, Rupprecht HJ, vom Dahl J et al. Sodium-hydrogen exchangeinhibition: novel strategy to prevent myocardial injury following ischemia and reperfusion. Am J Cardiol 1999;83:19g–22g.
22. Packer M, Anker SD, Butler J, Filippatos G, Zannad F. Effects of sodium-glucose cotransporter 2 inhibitors for the treatment of patients with heart failure: proposal of a novel mechanism of action. JAMA Cardiol. 2017;2:1025–9.
23. Iacobellis G. Local and systemic effects of the multifaceted epicardial, adipose tissue depot. Nat Rev Endocrinol. 2015;11:363–71.
24. Sato T, Aizawa Y, Yuasa S, Kishi S, Fuse K, Fujita S, et al. The effect of dapagliflozin treatment on epicardial adipose tissue volume. Cardiovasc Diabetol. 2018;17:6.
25. Muskiet MH, van Raalte DH, van Bommel EJ, Smits MM, Tonneijck L. Understanding EMPA-REG OUTCOME. Lancet
Diabetes Endocrinol. 2015;3:928–9.
26. Cherney DZ, Perkins BA, Soleymanlou N, et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Circulation. 2014;129:587–97.
27. Sano M, Goto S. Possible mechanism of hematocrit elevation by sodium glucose cotransporter 2 inhibitors and associated beneficial renal and cardiovascular effects. Circulation. 2019;139:1985–7.
28. Sano M, Takei M, Shiraishi Y, Suzuki Y. Increased hematocrit during sodium-glucose cotransporter 2 inhibitor therapy indicates recovery of tubulointerstitial function in diabetic kidneys. Journal of clinical medicine research. 2016;8:844–7.
29. Inzucchi SE, Zinman B, Fitchett D, Wanner C, Ferrannini E, SchumacherM, et al. How does empagliflozin reduce cardiovascular mortality? Insights from a mediation analysis of the EMPAREG OUTCOME trial. Diabetes Care. 2018;41:356–63
30. Bonner C, Kerr-Conte J, Gmyr V, Queniat G, Moerman E, Thévenet J, et al. Inhibition of the glucose transporter SGLT2 with
dapagliflozin in pancreatic alpha cells triggers glucagon secretion. Nat Med. 2015;21:512–7.
31. Ferrannini E, Mark M, Mayoux E. CV protection in the EMPAREG OUTCOME trial: a “thrifty substrate” hypothesis. Diabetes Care. 2016;39:1108–14.
32. Shimazu T, HirscheyMD, Newman J,HeW, ShirakawaK, le Moan N, et al. Suppression of oxidative stress by beta hydroxybutyrate, an endogenous histone deacetylase inhibitor. Science (New York, NY). 2013;339:211–4.
33. Ceriello A, Genovese S, Mannucci E, Gronda E. Glucagon and heart in type 2 diabetes: new perspectives. Cardiovasc Diabetol.
2016;15:123.
34. Lahnwong S, Chattipakorn SC, Chattipakorn N. Potential mechanisms responsible for cardioprotective effects of sodium-glucose co-transporter 2 inhibitors. Cardiovasc Diabetol. 2018;17:101.
35. Ferrannini E, Ramos SJ, Salsali A, Tang W, List JF. Dapagliflozin monotherapy in type 2 diabetic patients with inadequate glycemic Curr Cardiol Rep (2019) 21:130 Page 13 of 14 130control by diet and exercise: a randomized, double-blind, placebocontrolled, phase 3 trial. Diabetes Care. 2010;33:2217–24.
36. Banerjee SK,McGaffin KR, Pastor-SolerNM, Ahmad F. SGLT1 is a novel cardiac glucose transporter that is perturbed in disease states. Cardiovasc Res. 2009;84:111–8.
37. Ramratnam M, Sharma RK, D'Auria S, Lee SJ, Wang D, Huang XYN, et al. Transgenic knockdown of cardiac sodium/glucose
cotransporter 1 (SGLT1) attenuates PRKAG2 cardiomyopathy, whereas transgenic overexpression of cardiac SGLT1 causes pathologic hypertrophy and dysfunction in mice. J Am Heart Assoc.2014;3.
38. Meng L, Uzui H, Guo H, Tada H. Role of SGLT1 in high glucose level-inducedMMP-2 expression in human cardiac fibroblasts.Mol Med Rep. 2018;17:6887–92.
39. Seidelmann SB, Feofanova E, Yu B, Franceschini N, Claggett B, Kuokkanen M, et al. Genetic variants in SGLT1, glucose tolerance, and cardiometabolic risk. J Am Coll Cardiol. 2018;72:1763–73.
40. Ohgaki R, Wei L, Yamada K, Hara T, Kuriyama C, Okuda S, et al. Interaction of the sodium/glucose cotransporter (SGLT) 2 inhibitor canagliflozin with SGLT1 and SGLT2. J Pharmacol Exp Ther.2016;358:94–102.
